日立Hitachi超速离心如何助力肿瘤研究
肿瘤源的细胞外小囊泡(TEVs, Tumor-derived extracellular vesicles)通过在亲代细胞和受体细胞之间传递功能性生物分子,从而在癌症的进展过程中发挥关键作用。
TEVs对于其他器官的影响已被不断报道,这种效果主要是因为被包封的生物活性物质,包括脂质体、蛋白质、核酸和代谢物。一些研究解释了TEVs的功能,包括肿瘤发生、转移生态位的形成和影响免疫平衡。TEVs的分离对研究其生理功能及诊断和治疗应用具有重要意义。
近期,来自武汉大学的科研人员以小鼠原发性乳腺肿瘤细胞为研究对象,提出了一种高效分离TEVs的新方案。这一方案通过差速超速离心法,仅用时4小时,就能从复杂的肿瘤细胞中提取出高纯度的TEVs。这不仅为深入研究TEVs的生理功能提供了可能,也为癌症的诊断和治疗开辟了新的思路:

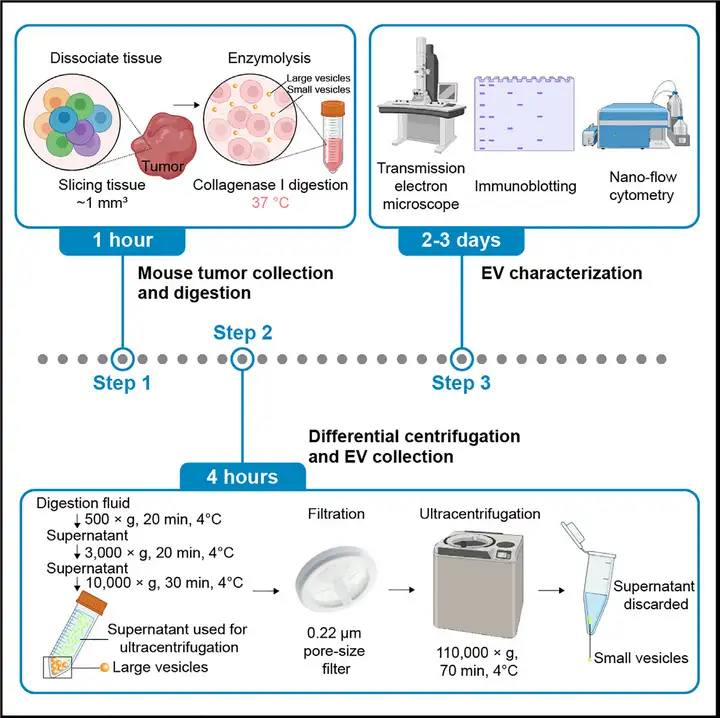
该方案包括了组织分离、酶消化和离心三步,该方案同样适用于从其他类型的实体瘤中提取EVs。
申明:执行任何实验方案都需要遵守当地机构关于实验室安全和伦理的指导方针。
选对离心方案:差速超速离心!TEVs 的“提纯术”
在将肿瘤细胞组织切片、分离和酶消化之后,对于关键分离步骤——离心部分的操作,研究人员用时4小时,通过多步差速离心的方式,依靠TEVs与杂质颗粒在大小和密度等不同参数的差异,将其分离出来。
为了获得较高纯度的TEVs并尽量提高收率,研究人员在离心操作过程中还分享了一些实用技巧和建议:
第一步离心:Eppendorf 5810R离心机,500 x g,20 min,4 ℃。
此步主要进行组织颗粒及细胞的沉淀分离,保留上清液。
第二步离心:Eppendorf 5810R离心机,3,000 x g,20 min,4 ℃。
此步目的是进一步去除组织碎片,保留上清液。
第三步离心:Sigma 1-14K微型离心机,10,000 x g,30 min,4 ℃。
此步的目的是去除较大细胞微泡(MVs)并富集小的TEVs,保留上清液。
取上清的操作要尽可能地快,以避免细胞沉淀再扩散。
可以在沉淀上方留下少量上清,以避免干扰上清。
取出的上清液需要用0.22µm孔径的针头滤器过滤,此操作中控制挤压过滤器的力度非常重要,因为用力太大可能会导致也MVs穿过过滤器。
第四步离心:Hitachi Himac CP80WX超速离心机,P50A3转头,110,000 x g, 70 min,4 ℃。
此步是为了收集小的TEVs,保留沉淀。
选用新的超速离心管,在装样之前,建议先用清水清洗离心管后再用ddH2O充分冲洗,因为管子内部的涂层会粘附TEVs并阻碍其沉淀。
可选操作:如果需要进一步纯化TEVs颗粒,可以将TEVs颗粒在2.5 mL PBS中重悬,然后将样品缓慢加到0.5 mL蔗糖/重水垫液层之上,然后110,000 x g, 70 min,4 ℃离心。
第五步离心:Hitachi Himac CP80WX超速离心机,P50A3转头,110,000 x g, 70 min,4 ℃。
此步是将前步沉淀在1 mL PBS中重悬后再次离心,将TEVs颗粒进一步纯化,保留沉淀。
离心后吸除上清时,建议在TEVs沉淀的对面进行操作,避免影响TEV沉淀。
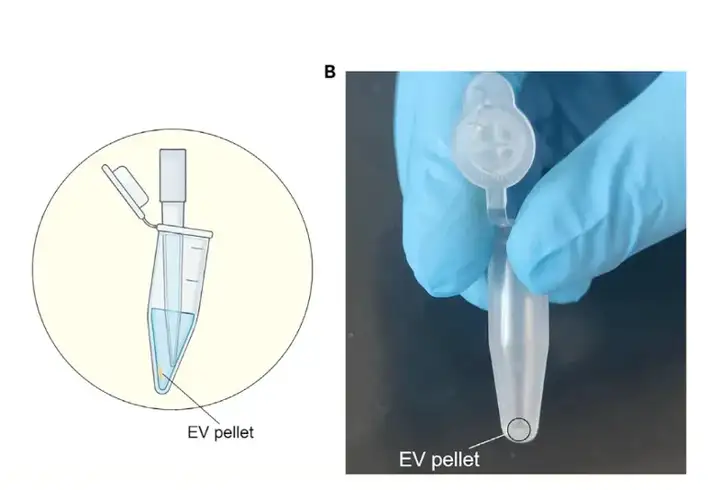
经过上述操作之后,将最后所得的TEVs沉淀在冰冷的无菌PBS缓冲液中重悬,即可作为透射电镜、免疫印迹和纳米流式细胞术的测试样品,可以对其进行进一步的鉴定和研究。
差速离心法分离TEVs是一种高效且高产的方法。然而与密度梯度离心、尺寸排阻层析、免疫沉淀和超滤等其他分离技术相比,该方法也存在一定的局限性。
差速离心操作相对简单,但并不适合一些痕量和珍贵样品的研究。
对于组织样品,使用过滤装置进行过滤操作是必不可少的,因为消化组织的成分包括一些复杂的囊泡干扰物,比如蛋白聚合物、细胞碎片和微生物。这些物质与TEVs尺寸相近,如果不进行过滤,将严重干扰TEVs后续的鉴定和生物学功能的研究。
过滤操作也会影响TEVs的浓度,导致其产量下降。
本文所描述的EV分离方案针对乳腺癌(BC)细胞异位移植瘤进行了优化,并将小鼠三阴BC(4T1)异位移植瘤作为实验模型进行了展示,在操作过程中也分享了一些可以获得高纯度EV和使收率最大化的实用技巧,对于其他类型的癌细胞异位移植瘤模型也具有参考价值。
CP-NX 系列超速离心机助力外泌体纯化
日立HitachiCP-NX 系列超速离心机(本文 CP80WX 是上一代机型)凭借其出色的性能,可实现细胞外囊泡的精细纯化。

随着科研技术的不断进步和肿瘤研究的深入发展,相信 Hitachi 超速离心机将在未来的癌症诊断和治疗中发挥更加重要的作用。


